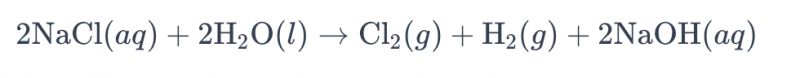Titaanelektroodide abil soolvee lahuse elektrolüüsi protsessi kloori saamiseks nimetatakse tavaliselt "soolvee elektrolüüsiks". Selles protsessis kasutatakse titaanelektroode kloriidioonide oksüdatsioonireaktsiooni hõlbustamiseks soolvees, mille tulemuseks on kloorgaasi teke. Reaktsiooni üldine keemiline võrrand on järgmine:
Selles võrrandis oksüdeeruvad kloriidioonid anoodil, mille tulemuseks on kloorgaas, samas kui veemolekulid redutseeruvad katoodil, mille tulemuseks on vesinikgaas. Lisaks redutseeruvad hüdroksiidioonid anoodil, moodustades vesinikgaasi ja naatriumhüdroksiidi.
Titaanelektroodide valik tuleneb titaani suurepärasest korrosioonikindlusest ja juhtivusest, mis võimaldavad sellel elektrolüüsi ajal stabiilselt ja korrosioonita reaktsiooni läbida. See teeb titaanelektroodidest ideaalse valiku soolvee elektrolüüsiks.
Soolase vee elektrolüüs vajab tavaliselt elektrolüütilise reaktsiooni energia tagamiseks välist toiteallikat. See toiteallikas on tavaliselt alalisvoolu (DC) toiteallikas, kuna elektrolüütilised reaktsioonid nõuavad voolu ühtlast suunda ja alalisvoolu toiteallikas suudab tagada konstantse voolu suuna.
Soolase vee elektrolüüsimisel kloorgaasi tootmiseks kasutatakse tavaliselt madalpinge alalisvooluallikat. Toiteallika pinge sõltub konkreetsetest reaktsioonitingimustest ja seadme konstruktsioonist, kuid jääb üldiselt vahemikku 2–4 volti. Lisaks on toiteallika voolutugevus oluline parameeter, mis tuleb määrata reaktsioonikambri suuruse ja soovitud tootmissaagise põhjal.
Kokkuvõttes sõltub soolase vee elektrolüüsi toiteallika valik katsete või tööstusprotsesside erinõuetest, et tagada tõhus reaktsioon ja soovitud saaduste saavutamine.
Postituse aeg: 16. jaanuar 2024